本文件主要涵盖了“GBT42398-2023细胞培养洁净室设计技术规范”相关内容,关于更多实验室建设问题可来电咨询,天元世纪竭诚为您服务!

前 言
本文件按照 GB/T 1 . 1—2020《标准化工作导则 第 1 部分:标准化文件的结构和起草规则》的规定起草 。
请注意本文件的某些内容可能涉及专利 。本文件的发布机构不承担识别专利的责任 。
本文件由全国洁净室及相关受控环境标准化技术委员会(SAC/TC319)归口 。
本文件起草单位:北京工商大学 、上海辰川生物技术发展有限公司 、中国电子系统工程第四建设有 限公司 、中国电子工程设计院有限公司 、苏州安泰空气技术有限公司 、中国人民解放军军事科学院军事 医学研究院 、湖南源品细胞生物科技有限公司 、河南辉煌空调净化工程有限公司 、中科检测技术服务(广 州)股份有限公司 、中电精泰电子工程有限公司 、深圳市北科生物科技有限公司 、国家卫生健康委科学技 术研究所 、中国医药生物技术协会 、中国科学院动物研究所 、华东理工大学 、中国食品药品检定研究院 、 中国建筑科学研究院有限公司 、江苏省人民医院 、众一伍德工程有限公司 、京东方再生医学科技有限公 司 、派欧尼尔环境净化工程(北京)有限公司 、上海市食品药品包装材料测试所 、苏州鸿基洁净科技股份 有限公司 、深圳市丽风净化工程有限公司 、浙江华源环境工程有限公司 、苏州英德尔室内空气技术有限 公司 、上海奇康再生医学技术有限公司 、杭州爱唯生命科技有限公司 、上海天迹洁净工程科技有限公司 、 上海朗脉洁净技术股份有限公司 、上海甘翼生物医药科技有限公司 、山东万事达建筑钢品股份有限公 司 、成都中增科教设备有限公司 、上海简朗工程技术有限公司 、浙江医药工业设计院有限公司 、上海开纯 洁净室技术工程有限公司 、戴文工程设计(上海)有限公司 、北京科源顺达建设工程有限公司 。
本文件主要起草人:朱学东 、马爱进 、吴朝晖 、张毅 、高华方 、王健 、赵同标 、蔡海波 、王立 、梁磊 、杨会英 、 孙会敏 、丁之洁 、赵伟 、陈思源 、徐绍坤 、张玮亮 、刘帅 、赵翔 、束永前 、李昂 、吴志坚 、曾世清 、魏佳鸣 、王坤 、 徐雪强 、陈中权 、严整辉 、晏坤 、任宏达 、陈国笋 、童广才 、傅宇岚 、王红卫 、赵娟 、魏建龙 、张骁 、钟家俊 、 刘吉宏 、谭莉平 。
引 言
本文件内容以细胞培养洁净室设计为主,需要注意的是洁净室的设计 、建造 、检测与应用是系统性 的,每个环节都很重要。另外,洁净室内空气化学污染对细胞培养的影响尚无定论。
制药领域的细胞培养洁净室在符合《药品生产质量管理规范》(GMP)的有关要求的基础上,可参考本文件。
细胞培养洁净室设计技术规范
1.范围本文件规定了细胞培养洁净室设计的一般要求 、通风净化 、围护结构 、电气和信息化 、给排水 、气体 管道 、安全要求 。
本文件适用于应用于人体的细胞培养之洁净室设计 , 其他细胞培养洁净室参照本文件 。
2.规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款 。其中 , 注 日期的引用文 件 , 仅该日期对应的版本适用于本文件;不注日期的引用文件 , 其最新版本(包括所有的修改单)适用于本文件 。
GB 5749 生活饮用水卫生标准
GB 17945 消防应急照明和疏散指示系统
GB/T 29469 洁净室及相关受控环境 性能及合理性评价
GB/T 36372 洁净室及相关受控环境 组合式围护结构通用技术要求
GB 50016 建筑设计防火规范
GB 50457 医药工业洁净厂房设计标准
GB 50472 电子工业洁净厂房设计规范
GB 50591 洁净室施工及验收规范
3.术语和定义下列术语和定义适用于本文件 。
3.1 细胞培养 cell culture使提取的细胞生长 、扩增并维持其生物学特性的过程 。
3.2 洁净室(间) cleanroom空气悬浮粒子浓度受控并分级的房间 。
注 : 该定义中的房间也可理解为由多个洁净间等组成的区域 。
[来源: GB/T 25915.1—2021.3.1.1 , 有修改]
3.3 洁净区 clean region洁净室(间)内进行关键工艺 、操作的特定空间 。
[来源: GB/T 25915.1—2021.3.1.2 , 有修改]
3.4 辅助区 support area洁净间外有一定洁净度要求 , 以 保证洁净间空气洁净度稳定性为主要 目 的 , 并为洁净间做相应准备 、服务工作的区域 。
3.5 缓冲区 buffer area辅助区内与无洁净度要求空间的通行区域 。其内可设某些功能区 。
注 : 较小规模的洁净室 , 在保证工艺要求的情况下 , 可将辅助区和缓冲区合并 。
3.6 单向流 unidirectional airflow通过洁净室或洁净区整个断面 , 风速稳定且平行的受控气流 。
[来源: GB/T 25915.1—2021.3.2.7]
3.7 非单向流 non-unidirectional airflow以诱导方式使洁净室的送风与室内空气混合形成的气流 。
[来源: GB/T 25915.1—2021.3.2.8 , 有修改]
3.8 感染因子 infectious agents携带细菌 、病毒 、真菌 、支原体 、寄生虫等致病性病原体的内源性或外源性生物样本 。
4.要求4.1 一般要求4.1.1 应结合细胞培养工艺及对环境的要求 , 开展选址 、通风净化 、围护结构 、电气和信息化 、给排水 、 气体管道 、安全等方面的设计 。
4.1.2 应选择振动 、电磁辐射 、噪声较小的区域 。新建洁净室面积大于或等于 3 000 m2 时 , 在满足前述 要求的同时 , 其所在建筑物应选自然环境好 、气体污染小的区域 。
4.1.3 新建及改 、扩建洁净室面积大于或等于 3 000 m2 时 , 洁净室设计应与其所在建筑的总体设计密 切衔接 。在与用户协商确定工艺要求和洁净室位置后 , 在与总体设计协商的基础上优先开展设计 , 并向 总体设计提出建筑结构 、动力 、暖通 、给排水 、电气等方面需求 。
4.1.4 应充分考虑制备工艺流程 、设备配置 、设备设施的安全可靠性 、各种接口 、人流 、物流 、物品存放 (必要的)危废物品原位灭活消毒 、施工安装 、设备安装 、检修维护等相关要求 。
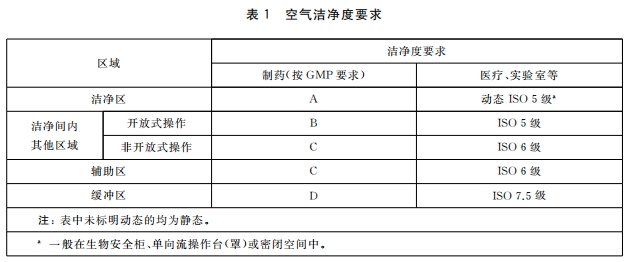
4.1.5 各区域洁净度等相关要求应符合4.2 。
4.1.6 应以保障人身安全为目的 , 考虑洁净室工作人员在紧急情况时尽快撤出 , 且尽量减少对洁净室 、 辅助区破坏的方案 。
4.1.7 在满足工艺要求及操作周期的基础上 , 注重节约能源 、保护环境 、经济合理 。
4.1.8 洁净室面积大于或等于 2000㎡ 时 , 应按 GB/T 29469 的要求进行设计评价 , 小于2000㎡ 的可自行选择是否进行设计评价 。
4.1.9 含有携带感染因子细胞培养的洁净室 , 应根据风险评估制定生物安全方案 , 确保其生产运行过 程不对人员和环境造成污染或危害 , 并避免交叉污染 。
4.1.10 以满足工艺要求 、4.2 的要求和安全可靠为前提 , 选用适宜的通风净化系统或系统组合 。
4.1.11 设备 、设施跨越不同空气洁净度等级的房间时 , 应安装牢固且有密封隔断措施 。传递窗宜酌情 设灭菌装置 。
4.1.12 新建洁净室应有便于检修 、维护的设备层 。
4.1.13 有液氮罐储存区域的 , 应设氧气含量检测仪 。
4.1.14 应注意新风源质量 。
4.1.15 注意核心工作区的气流方向及流速对细胞培养开放式操作的影响 , 并应预置相关调整方案。
4.2 洁净度及相关受控环境4.2.1 空气洁净度要求应符合表 1 的规定。
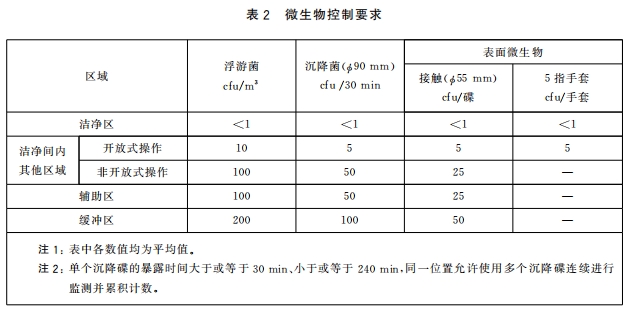
4.2.2 各区域的微生物控制要求应符合表 2 的规定。
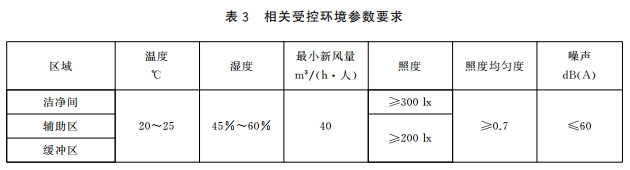
4.2.3 相关受控环境参数要求应符合表 3 的规定。
4.2.4 除携带感染因子细胞培养区域外,洁净室应维持一定正压。 不同洁净度的区域之间以及洁净室 缓冲区与无洁净度要求空间之间的静压差应不低于 8 pa~10 pa, 同级别房间根据工艺要求保持明确的气流流向。
4.2.5 有静压差要求的洁净室,在入口处应安装压力显示装置,并标识压差波动合理范围,压力显示装 置量程应与洁净室压力变化范围相匹配。
4.3 空气净化与调节4.3.1 通风净化系统4.3.1.1 应根据工艺要求 、工序特性和设备等因素,按要求保持不同区域的洁净度级别。
4.3.1.2 系统冷 、热源应能保障全年不同季节的温湿度要求(需同时考虑其内各种设备的热湿负荷) 。 注 : 关注极端气候,特别是持续极值温湿度的冷热源需求。
4.3.1.3 净化空调系统的划分应根据工艺要求 、平面布置 、生物安全等情况,经技术经济比较后确定,采 取有效措施避免污染和交叉污染,并符合下列规定 :
a)应与无洁净度要求区域分开设置空调系统 ;
b)工艺要求不同的生产单元,应分开设置净化空调系统 ;
c)运行班次或使用时间不同的功能区域,宜分开设置净化空调系统 ;
d)室内热湿负荷特性差别较大的区域,宜分开设置净化空调系统。
4.3.1.4 洁净室内有生物安全柜 、局部排风装置等通风设备时,应有在设备启闭和运行过程中维持室内 压力稳定的措施。
4.3.1.5 要有利于洁净室消毒灭菌 、自动控制和节能运行,并符合下列规定 :
a)正压洁净室宜采用循环风空调系统 ;
b)涉及有毒 、有害 、可燃物气体产生时(不含携带感染因子细胞培养区),应根据风险评估采用局 部或整体全排风系统 ;
c)应有消毒灭菌结束后房间气体稀释和置换措施。
4.3.1.6 洁净室排风系统的设计符合下列规定 :
a)不同净化空调系统的排风系统宜独立设置 ;
b)产生有害物质 、异味 、大量热 、湿或挥发性气体时,应单独设置排风系统 ;
c)应采取防止室外气体渗入的措施 ;
d)对含有水蒸气和凝结性物质的排风系统,应设置坡度,并在管道局部最低点设排放口 。
4.3.1.7 采用循环风的空调系统洁净室回风口处宜酌情设置初(中)效空气过滤器。
4.3.1.8 净化空调系统的送风 、回风和排风的启闭应连锁,并符合下列规定 :
a)正压洁净间连锁程序为先启动送风机,再启动回风机(如果有)和排风机,关闭时连锁程序应 相反 ;
b)负压洁净间连锁程序为先启动回风机和排风机(如果有),再启动送风机,关闭时连锁程序应 相反。
4.3.2 气流组织4.3.2.1 气流符合下列规定 :
a)洁净区应采用单向流流型 ;
b)洁净区之外的区域可采用非单向流流型,非单向流流型需减少涡流区 ;
c)气流分布应均匀,气流流速应满足生产工艺和人体卫生的要求。
4.3.2.2 非单向流洁净室内设置单向流工作台时,其位置应避免靠近送 、回风口 。
4.3.2.3 有局部排风装置时 , 宜布置在洁净室(区)的下风侧 。
4.3.3 部件与材料应符合 GB 50457 和 GB 50591 的相关要求 。4.3.4 携带感染因子细胞培养区域特殊要求4.3.4.1 应与相关工艺人员联合制定该区域各种工况(运行与否 、设备设施进出 、检修 、排除故障等)的 生物安全方案 。
4.3.4.2 携带病毒的细胞培养区与相邻房间或相邻区域应保持负压 , 且压差不小于 10 pa 。
4.3.4.3 开放式操作 , 应在 Ⅱ级 B2 生物安全柜 、隔离器等内进行 。
4.3.4.4 排风应经高效空气过滤器过滤后排放 , 其排风口应远离进风口和人员活动区域 , 并设在高于半 径 15 m 范围内建筑物高度 3 m 以上的地方 , 距离最近的建筑物的门 、窗 、通风采集口等的最小距离不 少于 20 m 。排风用高效空气过滤器应可进行原位检漏和消毒灭菌 。
4.3.4.5 Ⅱ级 B2 生物安全柜应与排风管密闭连接 , 保证安全柜内气体 100%外排 。
4.4 围护结构4.4.1 本条款适用于制药和用于细胞治疗的细胞培养洁净室 。
4.4.2 应符合 GB/T 36372 的要求 。
4.4.3 各种相关管线应置于围护结构之内不裸露 。
4.4.4 各种操控设施应采用镶嵌式 , 且表面平整 , 无清洁死角 。
4.5 电气和智能信息化4.5.1 配电4.5.1.1 重要用电设备应由双路电源供电 , 且从配电室采用放射式专用线路配电 。特别重要的细胞制 备洁净室宜有备用电源保障(如不间断电源 、发电机等) 。
4.5.1.2 不间断电源系统应具有旁路功能 , 或采取其他措施 , 在不间断电源系统使用过程中进行检修或 排除故障时 , 保证持续供电 。
4.5.1.3 供配电系统的自动转换装置宜具有旁路功能 , 或采取其他措施 , 在 自动转换装置检修或故障 时 , 不应中止供电 。
4.5.1.4 功率较大的设备宜由配电室直接供电 。
4.5.1.5 消防用电设备应符合 GB 50016 的有关规定 。
4.5.2 照明4.5.2.1 照明灯具具宜采用洁净室专用灯具 。灯具的检修和更换应避免对洁净室环境造成不利影响 。
4.5.2.2 各区域照度和照度均匀度符合表 3 的要求 。
4.5.2.3 应设置应急照明和疏散照明 , 应符合 GB 17945 的规定 。
4.5.3 智能信息化系统4.5.3.1 应设置消防安全应急广播 。
4.5.3.2 以下条款适用于有智能信息化需求的细胞培养洁净室 。
4.5.3.3 架构和系统配置应满足业务系统及管理系统对网络细分的要求 , 且应满足信息安全对网络物 理隔离及逻辑隔离的要求 。应满足能相关功能需求 , 提高运行效率 、可靠性和安全性 。
4.5.3.4 应提供开放 、符合国际通用及国家现行有关标准的通信接口和协议 。
4.5.3.5 应能根据使用需求设置用户操作界面 。
4.5.3.6 宜设置受控环境参数监测系统 。
4.5.3.7 可根据生产管理和生产工艺的要求设置闭路电视监视系统 , 能全过程 、多角度 、无死角实时观 看并记录 。
注 : 自动监控装置吸顶安装 。
4.5.3.8 应按照功能分区设置门禁管理系统 , 门禁管理系统应和紧急逃生 、火灾自动报警系统实现联动 控制 , 门禁系统在出现紧急情况或火灾时应自动解除 , 保证疏散时应急逃生通道畅通 。
4.5.3.9 应有便于与相关部门联系的通信系统 。
4.5.3.10 使用易燃 、易爆等危险品介质时 , 应在室内和监控室设置对应的监视报警装置 。
注 : 4.5.1 和 4.5.3 适用于制药和用于细胞治疗的细胞培养洁净室 。
4.6 给排水4.6.1 一般规定4.6.1.1 应符合 GB 50472 、GB 50457 的相关要求 。
4.6.1.2 给排水支管穿过洁净室顶棚 、墙壁和楼板处应设套管 , 管道与套道之间应有可靠的密封措施 。
4.6.1.3 管道外表面应采取防结露及防烫伤措施 。
注 : 本条适用于制药和用于细胞治疗的细胞培养洁净室 。
4.6.2 给水4.6.2.1 水质应符合 GB 5749 的要求 。
4.6.2.2 给水管材及配件应耐腐蚀 、安装连接方便 。
4.6.3 排水4.6.3.1 排水系统应根据排出的废水性质 、浓度和水量等特点确定 。
4.6.3.2 洁净室内的排水设备以及与重力回水管道相连的设备 , 应在其排出 口 以下部位设水封装置 。
水封高度不宜小于 50 mm , 工艺设备的排水口应设置空气阻断装置 。排水系统应有完善的通气系统 。
4.6.3.3 排水立管不应穿过洁净度高于或等于 ISO 6 级及其对应级别的洁净间 。排水立管穿过其他洁 净间时不应设检查口 。
4.6.3.4 ISO 5 级 、6 级及其对应级别洁净室内不应设置地漏 。低于上述级别要求的洁净室如必须设置 时 , 要求地漏材质不易腐蚀 , 内表面光洁 , 不易结垢 , 有密封盖 , 开启方便 , 应耐消毒灭菌 , 且能防止废水 废气倒灌 。
4.6.3.5 洁净室内应采用不易积存污物 , 易于清扫的卫生器具 、管材 、管架及其附件 。
4.6.3.6 洁净室排水系统宜根据有毒和无毒性质及排水温度分别设置 。
4.6.3.7 排水管道材料应按排水水质 、温度合理选择 。
4.6.4 工艺用水4.6.4.1 工艺用水的水质应符合生产工艺要求的质量标准 。
4.6.4.2 制水工艺流程应根据原水水质 、生产工艺对水质要求进行选择 。
4.6.4.3 纯化水 、注射用水的储存 、分配和输送应有防止微生物滋生和污染的措施 , 应设置清洗 、消毒 设置 。
4.6.4.4 纯化水 、注射用水的分配输送应采用连续循环的密闭系统 , 应避免死角 、盲管 。循环供水流速宜大于 1.5 m/s , 循环回水流速不应小于 1 m/s , 不循环支管长度不大于支管直径的 3 倍 。
4.6.4.5 纯化水和注射用水分配输送的管道 、泵 、管件等应采用无毒 、耐腐蚀 、耐消毒的材料,应采用内 壁抛光的优质不锈钢或其他不污染纯化水和注射用水的材料 。
4.7 气体管道4.7.1 应符合 GB 50457 的相关要求 。
4.7.2 洁净间内各类气体管路均应设指明内容物及流向的标志 。
4.8 安全与消防4.8.1 洁净面积大于或等于 2000㎡时,应规划应急通道,该通道应有明显标示且是通往室外的较为 便捷途径,规划的应急通道不应安装设备或放置物料以免影响其通畅性 。
4.8.2 出现有可能危及人身安全的紧急意外情况时,应有第一时间通知携带感染因子细胞培养洁净室 人员的警示装置,以便于采取紧急生物安全措施 。
4.8.3 应从生物安全角度为携带感染因子细胞培养洁净室人员设置专用应急通道和洁净室外隔离 区域 。
4.8.4 应在建设材料和具体应用(操作)时严格准守各种防火规范,杜绝各种火灾隐患 。
4.8.5 宜共用洁净室周边消防设施,尽量避免在洁净室内设置消防设施 。 如需在洁净室 、辅助区设置 消防设施,应符合洁净要求,并满足 GB 50016 的有关规定 。
参 考 文 献
[1] GB/T 25915.1洁净室及相关受控环境 第 1 部分:按粒子浓度划分空气洁净度等级